Stan prac nad lekiem i szczepionką na koronawirusa

Koronawirus, COVID- 19 w natarciu. Minął kolejny tydzień samoizolacji i pracy z potomstwem u boku. Zaczęłam się już pomału przyzwyczajać, więc może jednak nie stoczę się w otchłań szaleństwa jak się obawiał Kot w Butach w Shreku 2. Chociaż nigdy nic nie wiadomo, bo od czasu do czasu podczytuję internet albo słucham radia (telewizji nie mam od lat). Pandemia szaleje. Czasem przebija się jakiś news o szczepionce albo lekarstwie, ale wrażenie jest takie, że pracuje nad nimi tylko kilka firm. Dlatego postanowiłam sprawdzić jak NAPRAWDĘ wygląda aktualny stan prac nad lekiem i szczepionką na koronawirusa. Ile tego jest, gdzie są prowadzone badania i kiedy zobaczymy jakieś rezultaty.
Prace nad lekiem i szczepionką na koronawirusa: 532 BADANIA KLINICZNE
Po pierwsze, to nie tak, że prace nad lekiem albo szczepionką prowadzi tylko kilka firm na świecie. Według stanu na 4 kwietnia 2020r. na świecie zarejestrowano łącznie 532 badania kliniczne dotyczące koronawirusa.
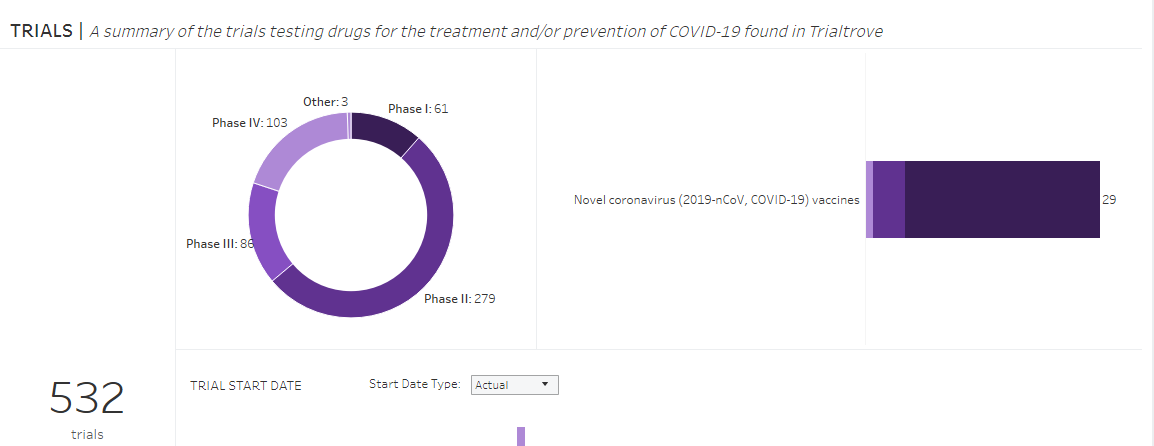
Badań przybywa w kosmicznym tempie, bo dla porównania, jeszcze 3 kwietnia, było ich 522.
TYLKO 29 BADAŃ KLINICZNYCH NAD SZCZEPIONKĄ NA KORONAWIRUSA
Jak widzisz niestety większość badań prowadzona jest obecnie nad lekiem, a nie nad szczepionką. Na dzień 4 kwietnia 2020 zaledwie 29 badań to badania szczepionkowe.
Co więcej, w przytłaczającej większości prace nad szczepionką nie wyszły jeszcze poza II fazę badań klinicznych. O tym czym są fazy badań klinicznych nad lekami i dlaczego do rejestracji leku potrzebne są minimum III, pisałam już we w wpisie o badaniach klinicznych nowych leków . Ta sama zasada dotyczy też szczepionek. Tutaj przypominam Ci tylko pokrótce, że w I fazie biorą udział zdrowi ochotnicy, a chorzy dopiero w II i III fazie. W III fazie bierze udział większa ilość chorych niż w II.
Wracając do tego jak toczą się prace nad lekiem i szczepionką na koronawirusa: jak widzisz, jesteśmy znacznie bliżej leku niż szczepionki.
Tym bardziej, że obecnie testuje się też jak już zarejestrowane i dopuszczone do obrotu, leki antywirusowe poradzą sobie z tym konkretnym koronawirusem. Stąd w powyższym diagramie też badania kliniczne IV fazy, czyli z użyciem zarejestrowanych lekarstw, które już można kupić.
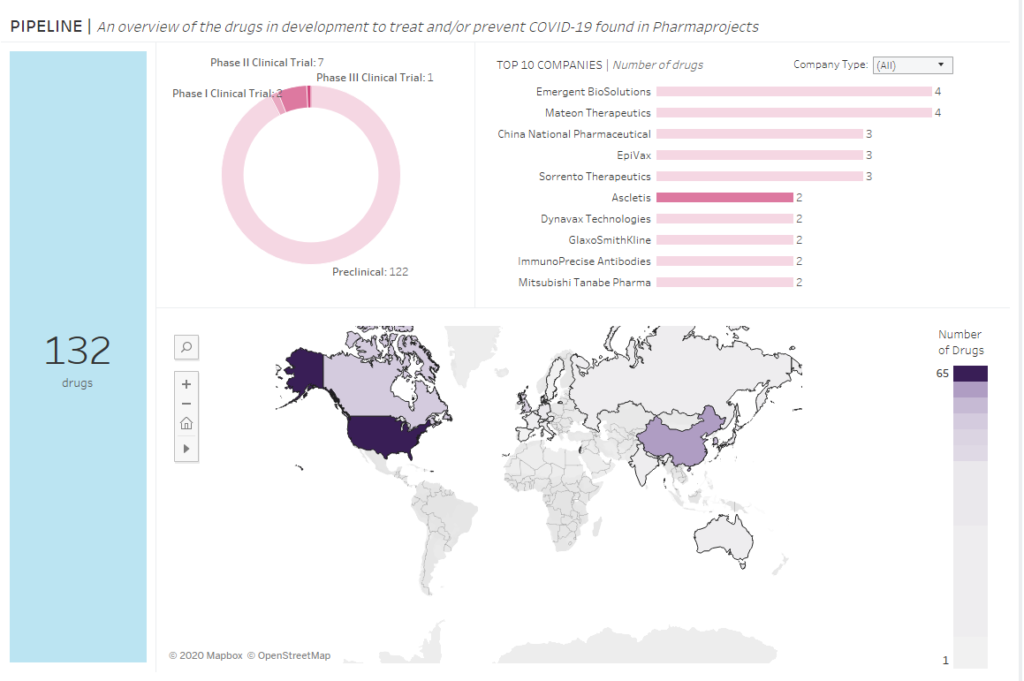
Prace nad lekiem i szczepionką na koronawirusa: kto i gdzie pracuje nad lekiem?
Obecnie na świecie są prowadzone 532 badania kliniczne nad szczepionką lub lekiem na koronawirusa, ale ….zgłoszono obecnie tylko 132 potencjalne leki. Z czego 122 są wciąż w tzw. fazie przedklinicznej, czyli nie wyszły poza testy w laboratoriach z testami na zwierzętach włącznie.
Dobra, to kto i gdzie pracuje nad tym lekiem na koronawirusa?
Odpowiedź jest dość łatwa do przewidzenia: przede wszystkim firmy farmaceutyczne z USA, poza tym Chińczycy, Kanadyjczycy i Japończycy. Do gry wkroczyła też potężny angielski koncern GlaxoSmithKline.
Szczegóły na poniższym diagramie:
Prace nad lekiem i szczepionką na koronawirusa: NAJBLIŻEJ LEKU CHIŃCZYCY?
Gdyby wnioskować wyłącznie z powyższych danych, to wydaje się, że najbliżsi wprowadzenie leku na koronarwirusa na rynek są Chińczycy. A dokładniej zarejestrowana w Hong Kongu biotechnologiczna firma Ascletis Pharma Inc, która testuje w tej chwili potencjalny lek w badaniu III fazy.
Ascletis bada możliwość leczenia pacjentów z koronawirusem danoprewirem skutecznym w nowoczesnym leczeniu wirusowego zapalania wątroby typu C. W największym skrócie: danoprewir zapobiega namnażaniu się wirusa zapalenia wątroby typu C uniemożliwiając przetłumaczenie informacji genetycznej wirusa na konkretną strukturę białek. Czyli wirus nie może się „podłączyć” do ludzkiego organizmu tak, żeby się swobodnie w nim rozmnażać.
I tu wielkie „pardon” i przepraszam wszystkich specjalistów. Jeśli coś pomieszałam albo za bardzo uprościłam, to po prostu dajcie znać w komentarzach.
Ważne, że, danoprewir może utrudnić życie koronawirusowi tak samo jak wirusowi zapalenia wątroby. A przynajmniej tak twierdzą szefowie Ascletis Pharma Inc.

Prace nad lekiem i szczepionką na koronawirusa: Czy da się to jakoś organizacyjnie przyspieszyć?
Jeśli czytałeś moje poprzednie wpisy o Agencji Badań Medycznych oraz badaniach klinicznych, to wiesz, że takie badania trwają, kosztują i są bardzo mocno regulowane etycznie i prawnie. Nie da się przeskoczyć poszczególnych faz badań klinicznych, a na rozpoczęcia badania trzeba uzyskać zgodę etyczną i jakiś rodzaj pozwolenia administracyjno-prawnego.
Pytanie brzmi: skoro jesteśmy w bardzo wyjątkowej sytuacji, czy da się jakoś przyspieszyć albo wręcz pominąć pewne etapy, tak, żeby szczepionka czy lek na koronawirusa były szybciej dostępne?
Póki co odpowiedź brzmi: nie za bardzo, ale to się może zmienić.
18 marca 2020r. odbyło się wirtualne spotkanie przedstawicieli krajowych organów wydających pozwolenia na prowadzenia badań klinicznych zrzeszonych w ICMRA (ang. International Coalition of Medicines Regulatory Authorities) czyli Międzynarodowej Koalicji Regulatorów ds. Leków. Zaproszeni zostali też eksperci z WHO oraz przedstawiciele Komisji Europejskiej i Europejskiej Agencji Leków (ang. EMA – European Medicines Agency). Główne punkty i wnioski z obrad możesz przeczytać sam.
Eksperci odnieśli się sceptycznie do pominięcia poszczególnych faz badań klinicznych, aczkolwiek zaproponowali żeby prace nad lekiem i szczepionką na koronawirusa podlegały pewnym uproszczeniom.
I tak jeśli badania na zwierzętach okażą się obiecujące, można by dopuścić możliwość równoczesnych testów na ludziach. Z tym, że oczywiście po uzyskaniu odpowiednich świadomych zgód na udział w badaniu oraz prowadzeniu testów raczej na młodszych ochotnikach w fazie I.

Prace nad lekiem i szczepionką na koronawirusa: Czy da się przyspieszyć ocenę prawną ?
Podstawowy kłopot tkwi w tym, że nie istnieje, jeden, globalny system rejestracji badania klinicznego (czyli potwierdzenie, że badanie ma pozytywną etyczną i prawną ocenę).
Póki co każdy kraj na świecie reguluje proces rejestracji badań we własnym zakresie.
I każde prace nad lekiem i szczepionką na koronawirusa muszą spełnić krajowe wymogi rejestracyjne żaby badanie mogło się rozpocząć.
Dla przykładu nasz krajowy organ rejestracyjny, czyli Prezes Urzędu Rejestracji Leków, Wyrobów Medycznych i Produktów Biobójczych ( Prezes Urzędu) wydał 23 marca komunikat, w którym stwierdziła wprost, że ogłoszenie na terenie Polski stanu epidemii, żaden sposób nie wpływa na tryb doręczeń, składania dokumentacji czy podpisywania dokumentów. Wszystko będzie się po staremu odbywać zgodnie z przepisami kodeksu postępowania administracyjnego (KPA). I trudno oczekiwać, że miałoby być inaczej, bo przepisy KPA wciąż obowiązują – stan epidemii niczego tu nie zmienił.
Szczęściem dla nas wszystkich, ani przepisy KPA ani prawa farmaceutycznego nie zabraniają Prezesowi Urzędu maksymalnie przyspieszyć rozpatrzenie wniosku o pozwolenie na prowadzenie badania klinicznego nad lekiem lub szczepionką na koronawirusa.
I Prezes Urzędu ma najwyraźniej zamiar skorzystać z tej możliwości, bo w komunikacie z 17 marca poprosił o oznaczenie dokumentacji dotyczącej badan na COVID-19 przez dodanie na pierwszej stronie dopisku “dotyczy koronawirusa SARS-CoV-2”.
Prezes podkreślił, że takie oznaczenie „pomoże pracownikom Urzędu w przyznawaniu pierwszeństwa sprawom związanym z koronawirusem SARS-CoV-2.”
Oczywiście to tylko deklaracja. Ale tego się trzymajmy.
Pozdrawiam, Prawstoria.
P.S. Tworząc wpis korzystałam z ogólnie dostępnych danych publikowanych i aktualizowanych przez serwis Pharmaintelligence.com specjalizujący się w gromadzeniu i opracowywaniu informacji na potrzeby przemysłu farmaceutycznego. Wszystkie raporty z których korzystałam są bezpłatne i ogólnie dostępne. Z tym, że materiały są publikowane wyłącznie po angielsku i japońsku.




